4个物理化学电解质溶液思维导图汇总,内容涵盖强电解质溶液、酸碱理论、弱酸和弱碱溶液的解离平衡、酸碱溶液pH的计算等4个方面,每张思维导图都非常简单,每张图片均高清晰可打印。
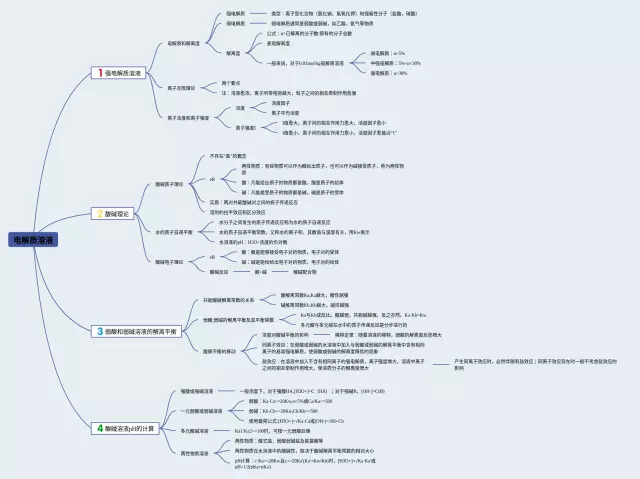
第1张,电解质溶液思维导图精选版
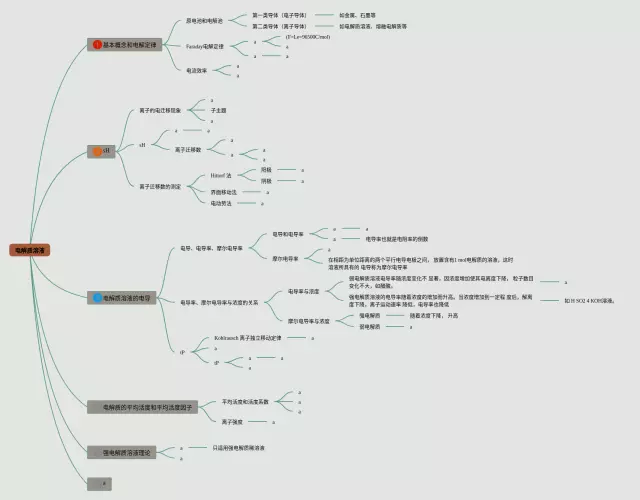
第2张,电解质溶液思维导图可打印
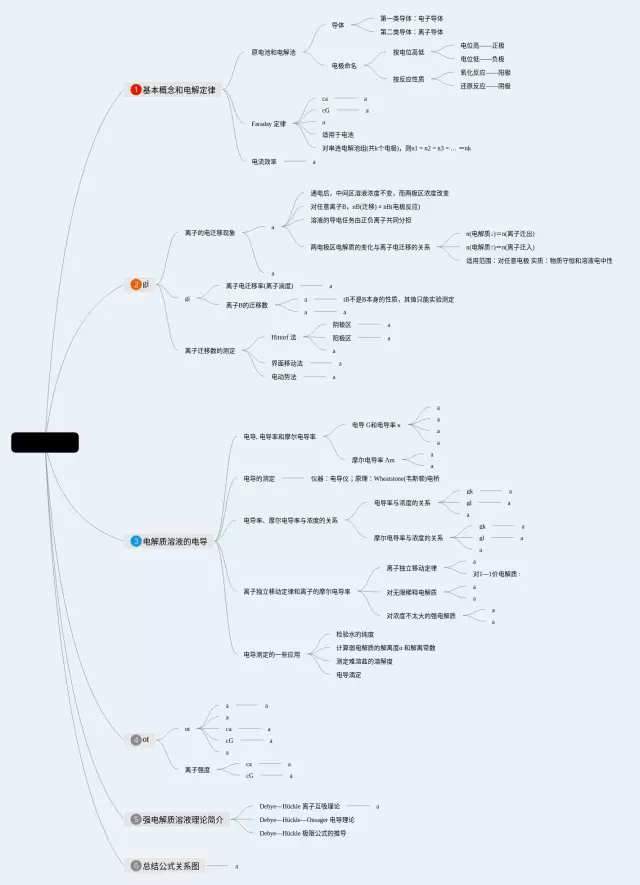
第3张,电解质溶液思维导图值得收藏
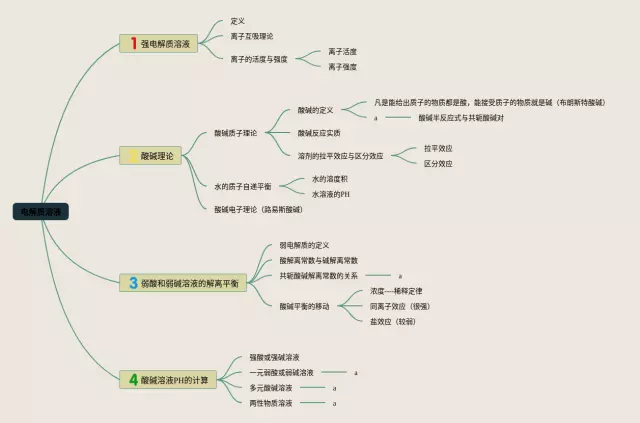
第4张,电解质溶液思维导图值得收藏
思维导图知识点说明:
- 强电解质溶液:
- 电解质和解离度:强电解质
- 离子互吸理论:两个要点
- 离子活度和离子强度:活度
- 酸碱理论:
- 酸碱质子理论:不存在“盐”的概念
- 水的质子自递平衡:水分子之间发生的质子传递反应称为水的质子自递反应
- 酸碱电子理论:eR
- 弱酸和弱碱溶液的解离平衡:
- 共轭酸碱解离常数的关系:酸解离常数Ka,Ka越大,酸性越强
- 弱酸弱碱的解离平衡及其平衡常数:Ka与Kb成反比。酸越弱,共轭碱越强,反之亦然。Ka·Kb=Kw
- 酸解平衡的移动:浓度对酸碱平衡的影响
- 酸碱溶液pH的计算:
- 强酸或强碱溶液:一般浓度下,对于强酸HA,[H3O+]=C(HA);对于强碱B,[OH-]=C(B)
- 一元弱酸或弱碱溶液:弱酸:Ka·Ca>=20Kw,α=500
- 多元酸碱溶液:Ka1/Ka2>=100时,可按一元弱酸处理
- 两性物质溶液:两性物质:酸式盐,弱酸弱碱盐及氨基酸等

Comments (0)